Ввод в обращение медицинского изделия (МИ) на территории РФ включает в себя следующие этапы:
- Технические испытания
- Токсикологические исследования
- Подготовка регистрационного досье на МИ с проведением I этапа экспертизы качества, эффективности и безопасности
- Клинические испытания МИ
- II этап экспертизы качества, эффективности и безопасности МИ
- Государственная регистрация мед. изделие с оформлением РУ
- Производство (изготовление)/ввоз и выпуск МИ на потребительский рынок

Регистрационное удостоверение (РУ) медицинского изделия – это официальный документ, который:
- удостоверяет факт регистрации мед. изделия Федеральной службой по надзору в сфере здравоохранения РФ (Росздравнадзором);
- разрешает свободный ввоз, производство, распространение и применение зарегистрированного мед. изделия на территории РФ;
- подтверждает факт внесения данного мед. изделия в Государственный реестр медицинских изделий Росздравнадзора.
РУ на мед. изделия выдаёт Росздравнадзор.
Какие документы необходимо для государственной регистрации мед. изделия
Для государственной регистрации мед. изделия Заявитель (производитель/изготовитель, уполномоченный представитель изготовителя, импортёр) должен доставить в Росздравнадзор следующие документы:
- Составленное в установленной форме Заявление о государственной регистрации МИ
- Документы, подтверждающие полномочия Заявителя и принадлежность МИ Заявителю, осуществляющему на законных основаниях их ввоз с целью государственной регистрации
- Нормативная,техническая и эксплуатационная документация на мед. изделие
- Фото (размером не менее 18х24 см) общего вида мед. изделия или интерфейса медицинского ПО
- Протоколы/Акты технических испытаний
- Протоколы/Заключения токсикологических испытаний
- Протоколы (акты, заключения) клинических испытаний по типовой программе (если такие проводились)
- Для импортируемых МИ: копии РУ и/или других документов, подтверждающих факт регистрации мед. изделия в стране-производителе
- Для импортируемых МИ: реквизиты Разрешения на ввоз образцов на территорию РФ для прохождения государственной регистрации
- Документы, подтверждающие возможность производителя изготавливать МИ (сертификаты СМК ГОСТ ИСО 13485 или др.)
- Другие имеющиеся у Заявителя документы, доказывающие качество, эффективность и безопасность заявленных МИ
Нормативная база

- № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» от 21.11.2011 г.
- Постановление Правительства РФ № 1416 «Об утверждении правил регистрации медицинских изделий» от 27.12.2012 г.
- Приказ № 2н от 09.01.2014 г. «Об утверждении порядка оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий»
- Приказ № 89н от 15.18.2012 г. «Об утверждении Порядка проведения испытаний в целях утверждения типа средств измерений, а также перечня медицинских изделий, относящихся к средствам измерений в сфере государственного регулирования обеспечения единства измерений, в отношении которых проводятся испытания в целях утверждения типа средств измерений»
- Приказ № 11н от 19.01.2017 г. «Об утверждении требований к содержанию технической и эксплуатационной документации производителя (изготовителя) медицинских изделий»
- Решение ЕЭК от 12 февраля 2016 года № 46 "О Правилах регистрации и экспертизы безопасности, качества и эффективности медицинских изделий"
- Постановление Правительства Российской Федерации от 01.04.2022 г. № 552 «Об утверждении особенностей обращения, включая особенности государственной регистрации, медицинских изделий в случае их дефектуры или риска возникновения дефектуры в связи с введением в отношении Российской Федерации ограничительных мер экономического характера»
Какая продукция считается "Медицинским изделием"
Согласно части 1 статьи 38 № 323-ФЗ, медицинским изделием являются применяемые в медицинских целях отдельно или в сочетании между собой любые:
- инструменты,
- аппараты,
- приборы,
- оборудование,
- материалы,
- специальное программное обеспечение,
- и др.,
изготовленные для профилактики, диагностики, лечения и реабилитации заболеваний, проведения медицинских исследований, мониторинга болезней, фармацевтического и прочего воздействия на организм человека в медицинских целях.
Виды медицинских изделий, подлежащих государственной регистрации, перечислены в Приложении №1 Приказа Министерства здравоохранения РФ № 4н от 06.06. 2012 г.
В Приложении №2 настоящего Приказа приведён принцип определения мед. изделий по классам риска.
Виды испытаний медицинских изделий
Виды обязательных лабораторных исследований (испытаний), которые проходят все без исключения мед. изделий перед I (первым) этапом экспертизы в рамках процедуры государственной регистрации:
Технические
Токсикологические
По результатам анализа Протоколов (Актов. Заключений) испытаний, Экспертного заключения и других обязательных документов на мед. изделие, Росздравнадзор принимает Решение о целесообразности проведения клинических испытаний.
В отношении ряда медицинских изделий, в том числе 1-го (низкого) класса риска, государственная регистрация осуществляется по ускоренной процедуре – после первой экспертизы.
Как проходят технические испытания мед. изделий
Технические испытания – форма оценки соответствия мед. изделий установленным к ним требованиям эффективности, безопасности и качества
Технические испытания проводят аккредитованные лаборатории в порядке, утверждённом Минздравом РФ.
Приказ Минздрава России №2н Об утверждении Порядка проведения оценки соответствия МИ в целях госрегистрациЭтапы технических испытаний МИ:
- Подача Заявителем в испытательную лабораторию необходимых документов, сведений и материалов:
Заявление (установленного образца) о проведении тех. испытаний
Сведения о нормативной документации на заявленное изделие
Перечень стандартов и требований, которых соответствует заявленное на испытания медицинское изделие
Эксплуатационная и техническая документация на МИ
Конструкторская документация (чертежи, схемы и т.п.)
Фотоизображение общего вида МИ, установленного размера
Образцы мед. изделий
Материалы (спец. оборудование, ПО или др.), необходимые для проведения технических испытаний
При наличии: копии Протоколов (Актов, Заключений) проводимых ранее испытаний, сведения об опасности МИ и принятых мерах снижения остаточных рисков, сведения о клиническом применении МИ за пределами РФ, другие документы от производителя, сопровождающие конкретное мед. изделие - Анализ технической документации
- Идентификация МИ с определением класса потенциального риска и номенклатуры
- Согласование с Заявителем индивидуальной Программы тех. испытаний (при их проведении)
- Оценка соответствия МИ требованиям применимых стандартов, нормативной и эксплуатационно-технической документации
- Испытания образцов МИ по составленной Программе (при проведении испытаний)
- Определение качества и безопасности применения МИ
- Анализ полученных данных
- Доработка эксплуатационно-технической документации (при необходимости)
- Оформление и выдача Заказчику Протоколов испытаний и/или Акта оценки результатов технических испытаний медицинского изделия
Как проходят токсикологические испытания мед. изделий
-
Оценка соответствия медицинских изделий в форме токсикологических испытания предусмотрены для всех видов мед. изделий, так или иначе контактирующих с организмом человека
- Подача Заявителем в испытательную лабораторию следующих необходимых документов, сведений и материалов:
Заявление (установленного образца) о проведении токсикологических испытаний
Сведения о нормативной документации на заявленное изделие
Перечень стандартов и требований, которым соответствует конкретное медицинское изделие
Техническая, конструкторская и эксплуатационная и документация на заявленное МИ
Имеющиеся документы на материалы, субстанции, комплектующие
Для лекарственных средств (в случае их применения в составе мед. изделия): № фармакопейной статьи или № нормативной документации на фарм. субстанцию или на лекарственный препарат, включенную(ый) в государственный Реестр лекарственных средств
Копии Протоколов (Актов, Заключений) ранее проводимых испытаний, других имеющихся документов, характеризующих безопасность и качество заявленного МИ
Образцы МИ - Идентификация МИ
- Классификация МИ (определения класса риска и номенклатуры)
- Анализ доставленной документации
- Согласование с Заявителем индивидуальной Программы токсикологических испытаний
- Осуществление лабораторных исследований образцов
- Анализ и оформление результатов испытаний
- Выдача Заявителю отчёта о проведённых исследованиях в форме Протоколов и/или Заключения по результатам токсикологических исследований медицинского изделия
Что проверяют эксперты ООО "ЦСД" в процессе испытаний мед. изделий

Ключевые моменту проверки мед. изделия в рамках лабораторных испытаний:
- Оценка соответствия требованиям применимых стандартов и нормативной документации
- Оценка соответствия методов исследования и контролируемых характеристик требованиям конструкторской и эксплуатационно-технической документации производителя
- Оценка безопасности применения
В ходе технических испытаний проверяются показатели:
- физико-механические характеристики
- электромагнитная совместимость
- электробезопасность
В ходе токсикологических исследований проверяются показатели:
- Физико-химические
- Санитарно-химические
- Биологические (в условиях in vitro и in vivo)
Окончательный объём испытаний и контролируемых характеристик выбирается индивидуально для каждого вида мед. изделий.
Свяжитесь с экспертами нашего Центра и получите бесплатную консультацию по всем вопросам испытаний конкретного вида мед. изделия для целей прохождения гос. регистрации
Что надо делать Заявителю после испытаний мед. изделий
После получения положительных Актов, Заключений и/или Протоколов испытаний Заявитель:
- комплектует ими пакет обязательных документов Какие документы необходимо для государственной регистрации мед. изделия
- доставляет собранные документы в региональное подразделение Росздравнадзора;
- подаёт Заявление на гос. регистрацию своих МИ.
После рассмотрения Заявления и проверки документов Росздравнадзор формирует на заявленную продукцию регистрационное досье и отправляет его в уполномоченную экспертную организацию на первую экспертизу.
Дальнейших порядок действий определяется Росздравнадзором по результатам полученного Экспертного заключения.
Для получения протокола испытаний требуется
Учредительные документы,
Реквизиты заявителя,
Заявление,
Техническая документация
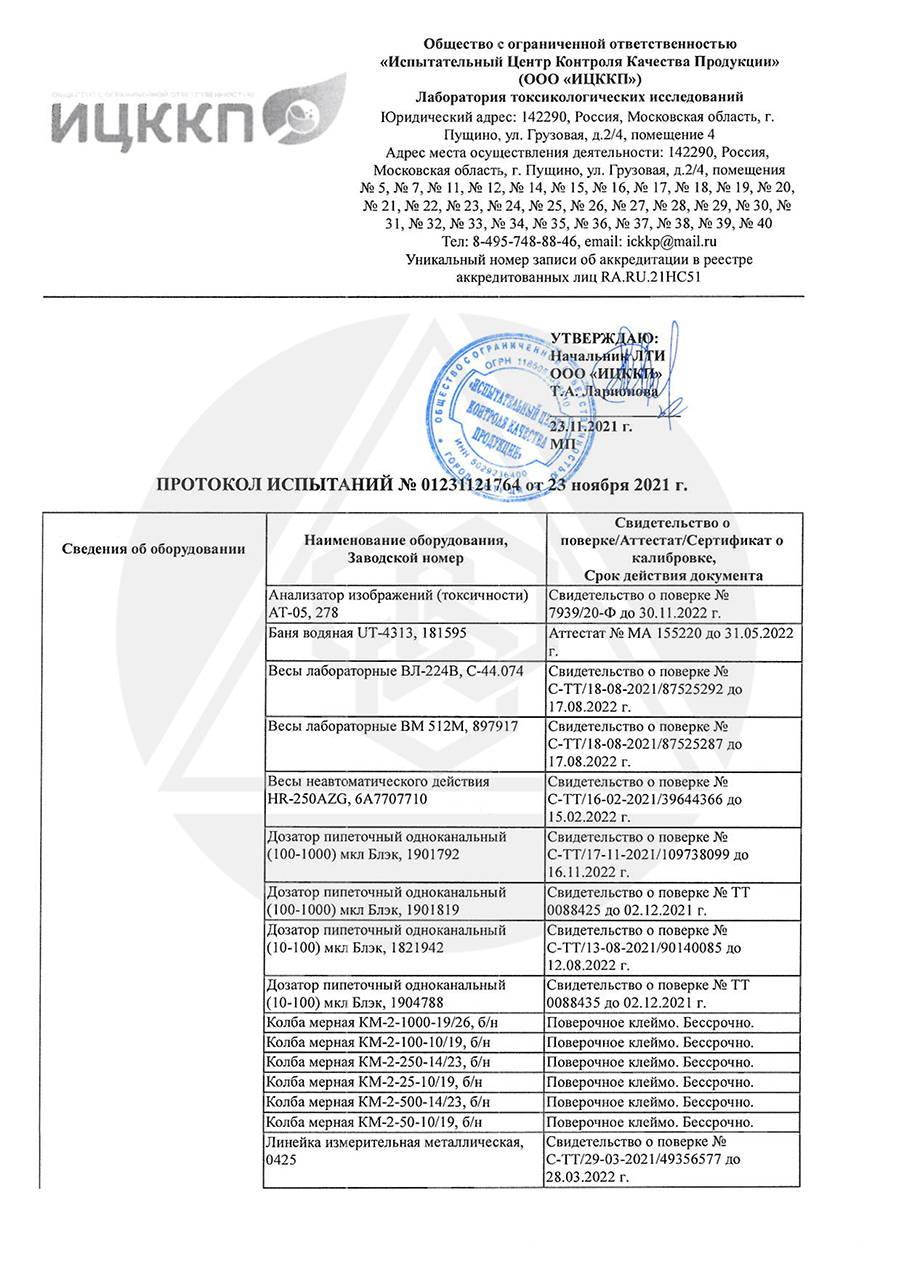
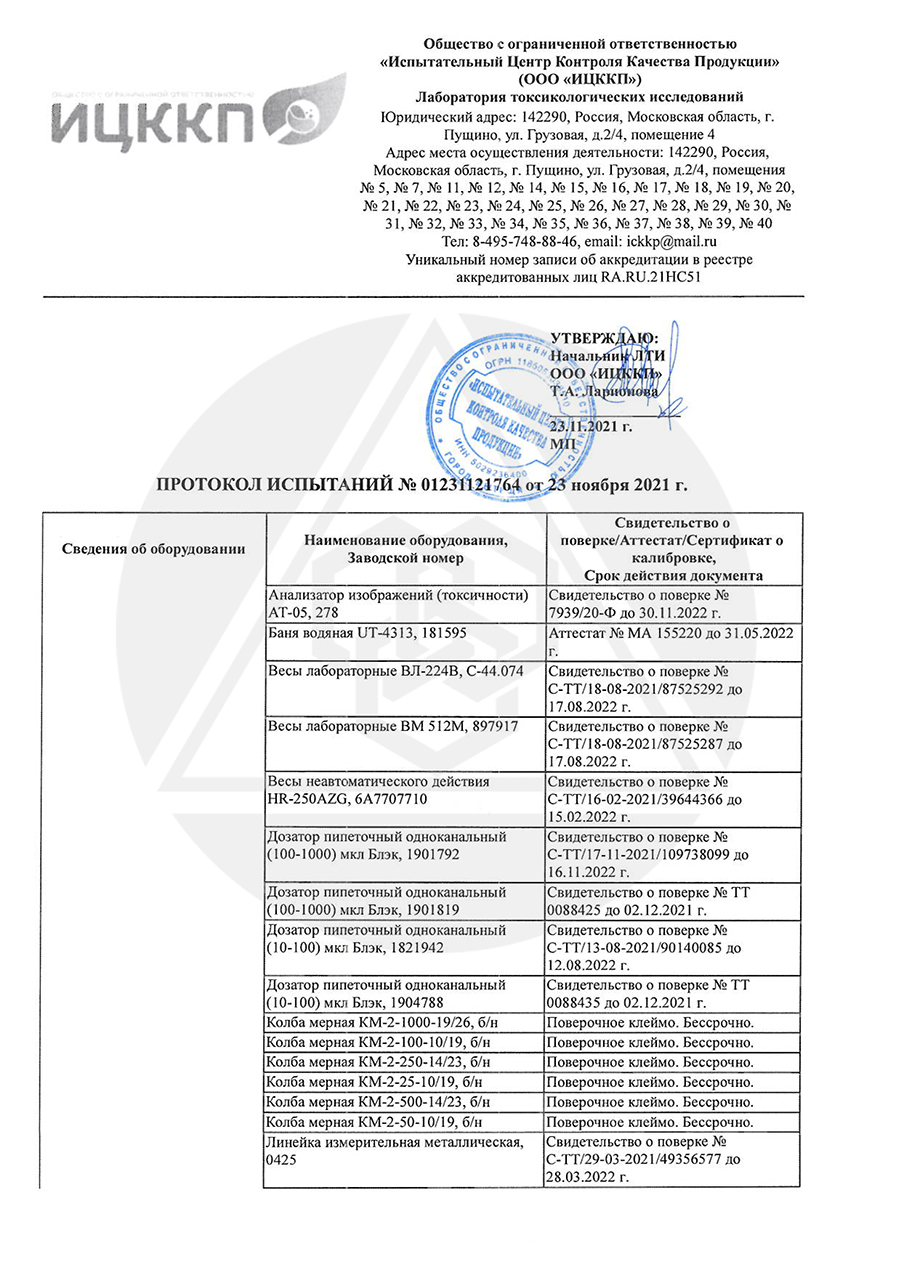
Аттестат аккредитации RA.RU.21HP36
Аттестат аккредитации RA.RU.21HA14
Аттестат аккредитации RA.RU.21HC51